① バグダット電池 |

[↑バグダッド電池]
[↑バグダッド電池の構造]
|
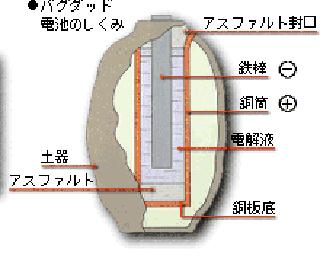
現在、世界で最も古いと考えられているのが「バグダット電池」である。今からおよそ2000年前(紀元前250年頃)に作られ、イラクの首都・バグダッド郊外にあるホイヤットランプファ遺跡で発見されたことからこの名が付いた。
大きさは高さ10cm、直径3cm程の小さな壺で、中に薄い銅の筒がはめ込まれ、真ん中に鉄棒が入っている。
壺底には電解液と思われる液体の痕跡があったが、それが正体は未だに謎に包まれている。又、電圧は1.5~2.0Vと推定されている。バグダッド電池が作られていた時代から約2000年後の1800年に発見されたボルタ電池の起電力は1.0V程度なので、かなり高度な電池である。
|
② ガルバノ電池 |

[↑Luigi Galvani]
[↑ガルバノ電池]
|
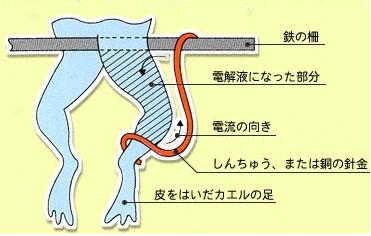
1780年、生物学者のガルバー二(伊)は、カエルの足の神経に黄銅(鉛Pbと銅Cuから成る)と鉄Feの2種類の金属を触れさせると足の筋肉がまるで痙攣を起こしたかのようにピクピク動くのを発見した。当時、解剖学の教授であったガルバーニはカエルの解剖実験中にこれを偶然発見し、この現象は生物の体内に電気があるからと推測した。そして、彼はこれを動物電気・ガルバノ電池と名付けた。
しかし、その後ガルバーニの仮説に異を唱える者が現れた。ボルタ電池の発見者であるボルタである。
|
| ③ ボルタ電池 |

[↑Alessandro Volta]

[↑ボルタ電池]
|
物理学者のボルタ(伊)は2種類の異なる金属を入れることでカエルの体液(塩水)が電解液となって電位差が生じるため電気が流れ、その結果ガルバーニが目のあたりしたような現象が見られたと証明した。
ガルバーニの発見した現象、及びその仮説から、ボルタは1800年頃電池の原理を解明した。そして、それを更に発展させて作られたのがボルタ電池である。負極に亜鉛Zn、正極に銅Cu、電解液に硫酸銅水溶液H2SO4を用いることによって電気が流れる。負極では
(負極) Zn → Zn2+ + 2e-
の反応が起こり、亜鉛イオンZn2+が出てくる。一方、正極では
(正極) 2H + + 2e- → H2
の反応が起こり、水素Hが発生する。
起電力は1.0Vで、大変画期的な発見であったが、1つ問題が生じた。上で示したイオン反応式を見ると、正極で水素H2が発生しているのが分かる。これによって正極の銅Cuが水素ガスの泡に覆われてしまい、電子の授受が行われにくくなり、最終的には電気が流れてなくなってしまう。その問題を解決したのがダニエルであった。
(余談だが、電圧の単位で用いられるV(ボルト)とは、他でもないこのボルタから取ったものである。)
|
| ④ ダニエル電池 |

[↑John Fredric Daniel]

[↑最初のダニエル電池]
|
ボルタが発明した電池は確かに画期的な物であったが、水素H2の発生のため電気が流れなくなるというデメリットがあった。そこで、ダニエル(英)は電解液を2つ使用し、正極に硫酸銅水溶液CuSO4、負極に硫酸亜鉛水溶液ZnSO4を用いた。又、2つの溶液が混合しないように素焼き板を使ったことも広く知られている。
1836年にダニエルが考案したこの電池は、硫酸亜鉛水溶液ZnSO4を使用したことで起電力を安定にすることができ、その起電力1.1V程である。更に、ボルタ電池とは違って、水素H2という不快な気体を発生させないため、大変素晴らしい電池であったと言えよう(下記のイオン反応式参照)。
(負極) Zn → Zn2+ + 2e-
(正極) Cu2+ + 2e- → Cu
|
⑤ ガストンの鉛蓄電池 |
[↑ガストンの鉛蓄電池] |
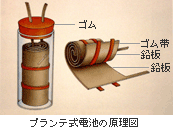
鉛蓄電池は1859年にガストン(仏)によって開発された二次電池(充電によって繰り返し使用できる電池のこと)である。その構造は2枚の鉛板(Pb)の間に2本のテープを挟み込み、それを包んで円筒状にしたものを希硫酸中H2SO4に入れたものである。正極に二酸化鉛(PbO2)、負極に鉛Pbを使用している。ボルタ電池などとは違い、繰り返し充電して使えることから、その後も世界各地で鉛蓄電池の改良が進んだ。その結果カーバッテリーなどが誕生し、今でも私たちの生活を支えてくれている。なお、その起電力は約2.1Vである。
(負極) Pb + SO42- → PbSO4 + 2e-
(正極) PbO2 + 4H+ + SO42- + 2e- → PbSO4 + 2H2O
|
⑥ ルクランシェの電池 |

[↑Georges Leclanche]
[↑ルクランシェの電池] |
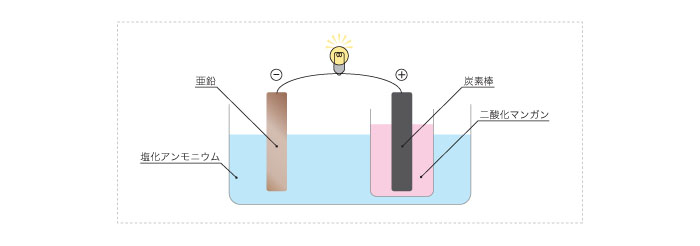
ダニエル電池の開発から数十年経った1867年、ルクランシュ(仏)がルクランシュ電池を開発。正極に炭素棒C、負極に亜鉛Znを用い、それぞれ二酸化マンガンMnO2、塩化アンモニウム水溶液NH4Clを電解液として使用した。
Zn → Zn2+ + 2e-
2NH4+ + 2MnO2 + 2e- → 2MnO(OH) + 2NH3
Zn2+ + 4NH3 → [Zn(NH3)4] 2+
現在の乾電池の原型だが、塩化アンモニウム水溶液NH4Clがこぼれるというデメリットがあったため、実生活においてはあまり使えなかった。他にも、手入れが面倒なこと、冬には薬品が凍結してしまうことなど様々な欠点があった。
|
⑦ 屋井先蔵の乾電池 |

[↑屋井先蔵]

[↑屋井先蔵の乾電池]
|
先に述べたように、ルクランシュの電池は様々な欠点があったため、日常での使用は些か困難であった。特に問題であったのが電解液が漏れ、金具が腐食して使えなくなってしまうことであった。そこで屋井先蔵は炭素棒にパラフィンをしみ込ませることによって金属の腐食を防ぐことに成功した。パラフィンとはCnH2n+2と一般式で表される炭化水素の総称で、化学的に安定で反応に乏しいため乾電池の開発にはぴったりであった。こうして1887年(明治20年)日本で最初の乾電池が誕生したのである。
|
⑧ ガスナー、ヘレセンスの乾電池 |

[↑ガスナーの乾電池] |
1867年にルクランシュが発明した電池は、電解液が漏れてしまうという欠点があった。そこで、1888年、ガスナー(独)は電解液をセメントで固めることによってそのデメリットを改善。これによって電池が家庭の様々な場所で活躍することとなった。又、同時期にヘレセンス(デンマーク)もこの方法を思いついたことから、彼の名もまた電池の歴史に残っている。
|
⑨ ユングナーのニッケル・カドミウム蓄電池 |

[↑ニッケル・カドミウム電池] |
1899年、ユングナー(スウェーデン)が新たに独自の電池を開発した。電解液に水酸化カリウム水溶液KOH、正極には主に水酸化ニッケルNiOHを用い、負極にはカドミウムCdの粉末を用いた。
(負極) Cd+2OH- → Cd(OH)2 + 2OH-
(正極) 2Ni(OH)3 + 2e- → 2Ni(OH)2 + 2OH-
特徴としては、低温で急に放電する性能が優れていること、適応温度範囲が-50~70℃と広いこと、自己放電が少ないこと、寿命が長く鉛蓄電池の4倍近くあることなどが挙げられる。又、一般に使用されているニッケル・カドミウム電池は1.2V程度である。
|
⑩ エジソンのニッケル・鉄蓄電池 |

[↑Thomas Alva Edison] |
1901年、エジソン(米)は水酸化ニッケル(Ⅱ)Ni(OH)2を正極、鉄粉Feから成る極板を負極に用いて独自の電池を開発した。電解液には、少量の水酸化リチウムLiOHを含む水酸化カリウム溶液KOHを使用。ユングナーのニッケル・カドミウム電池と大変よく似ているが、カドミウムCdは猛毒で、特にその化合物はイタイイタイ病の原因とされており、あまり環境に配慮した電池ではなかった。従って、エジソンが発明した電池は、カドミウムCdに代わって安価な鉄Feを使用していることから、経済的にも環境的にも良い電池であったと言えよう。 |
⑪ 空気電池 |
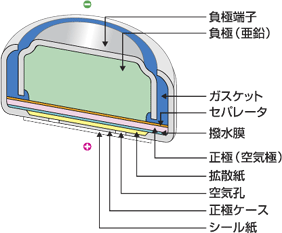
[↑空気電池の構造] |
1907年、フェリー(仏)によってウェットタイプの空気電池(別名:空気亜鉛電池)が考案された。この電池は正極に炭素C、負極に亜鉛Znを用い、電解液は塩化アンモニウムAlCl3を使用していた。
フェリーの発明から約30年後、日本でも本格的にウェットタイプの空気電池が生産され始めた。その特徴は、温度変化に強いこと、容量が大きいことが挙げられ、鉄道の踏み切り警報装置などに使われていた。
更に1970年代にはグールド社(米)がボタン型空気電池を開発し、今でも補聴器などに使用されている。その起電力は1.35V程度で、底部にあるシールをはがし、孔から空気を入れることで使用できる。
|
⑫ アルカリ乾電池 |

[↑アルカリ乾電池の構造] |
1947年、エバレディー社(米)が扁平形のアルカリ乾電池(別名:アルカリマンガン乾電池)を開発。正極に二酸化マンガンMnO2、負極に亜鉛Zn、電解液に水酸化カリウムKOH(水酸化ナトリウムNaOH)水溶液が使われている。特徴としては、長時間に渡って安定に電圧を保てること。その起電力は1.5V程度で、ヘッドホンステレオやCDラジカセに使用されている。 |
⑬ 酸化銀電池 |
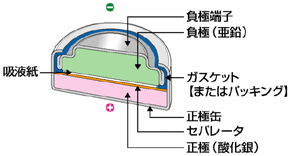
[↑酸化銀電池の構造] |
1960年に、エバレディー社(米)が、世界で初めてボタン形の酸化銀電池を商品化した。負極に亜鉛Zn、正極に酸化銀Ag2O、電解液に水酸化カリウム水溶液KOHが用いられている。寿命が長く、電圧が最後まで安定しているのが特徴で、その起電力は1.55V。
電子ゲーム機や計算機などに使われ、多量に生産されていたが、1979年から1980年にかけて銀の価格が高騰したことが原因で、酸化銀電池の価格もそれに比例して高騰。各企業は、これに替わる電池として太陽電池やコイン型リチウム一次電池を生産した。その後、銀の価格が下がったものの、酸化銀電池は受け入れられず、生産量が激減した。現在では腕時計やカメラの露出計に使われている。
|
⑭ ニッケル水素電池 |
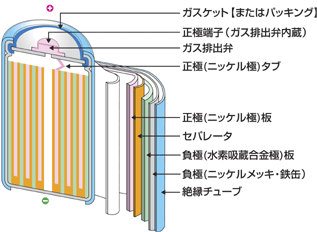
[↑ニッケル水素電池電池] |
ユングナーのニッケル・カドミウム電池を期に、その後様々な電池が開発された。その中でも、日本の経済成長を支えたと言われているのが1990年に世界で初めて、松下電池工業、三洋電機が相次いで量産化したニッケル水素電池である。この電池は、ニッケル・カドミウム電池の負極で使われていた猛毒・カドミウムを「水素吸蔵合金」(体積の約1000倍の水素H2を吸収して蓄えることがきる合金)に置き換えたもので、電圧もほぼ同じ1.2V。様々な電子機器の小型化を支えたのもこのニッケル水素電池である。 |
⑮ リチウムイオン電池 |

[↑リチウムイオン電池] |
電子機器の更なる小型化・高性能化を目指し、各企業の競争が激しくなる中、従来のニッケル水素電池に代わって新たな電池が開発された。リチウムイオン電池である。1991年、ソニー・エナジー・テックが開発したこの電池は、起電力が3.7Vとこれまでの電池とは比較にならないほど高く、それでいてリチウムLiの溶解・析出を伴わないため世界の注目の的となった。又、リチウムイオンLi+を吸蔵・放出できる正極と負極の組合せで成り立っているため、500回以上の充放電に耐える良好なサイクル特性が特徴である。具体的な電極材料としては、正極にコバルト酸リチウム LiCoO2、負極に炭素材料Cが用いられている。又、従来の電池に比べて軽量で、放電によって容量の低下が少ないことから、様々な電化製品に応用されていった。
|